Ordinul Ministerului Sănătății nr. 703/2015 - modificarea şi completarea anexei la Ordinul ministrului sănătăţii nr. 75/2009 pt. aprobarea Normelor - modul de calcul al preţurilor la medicamentele de uz uman şi pt....
| Comentarii |
|
MINISTERUL SĂNĂTĂȚII
ORDINNr. 703/2015
pentru modificarea și completarea anexei la Ordinul ministrului sănătății nr. 75/2009 pentru aprobarea Normelor privind modul de calcul al prețurilor la medicamentele de uz uman și pentru modificarea Ordinului ministrului sănătății nr. 245/2012 pentru aprobarea prețurilor la medicamentele de uz uman cuprinse în Catalogul național al prețurilor medicamentelor de uz uman autorizate de punere pe piață în România
Monitorul Oficial nr. 396 din 05.06.2015
Văzând Referatul de aprobare nr. N.B. 6.074/2015 al Direcției politica medicamentului și a dispozitivelor medicale din cadrul Ministerului Sănătății,
având în vedere prevederile art. 851 din Legea nr. 95/2006 privind reforma în domeniul sănătății, cu modificările și completările ulterioare,
în temeiul art. 7 alin. (4) din Hotărârea Guvernului nr. 144/2010 privind organizarea și funcționarea Ministerului Sănătății, cu modificările și completările ulterioare,
ministrul sănătății emite următorul ordin:
Art. I
Anexa la Ordinul ministrului sănătății nr. 75/2009 pentru aprobarea Normelor privind modul de calcul al prețurilor la medicamentele de uz uman, publicat în Monitorul Oficial al României, Partea I, nr. 62 din 2 februarie 2009, cu modificările și completările ulterioare, se modifică și se completează după cum urmează:
1.Articolul 2 se modifică și va avea următorul cuprins:
"Art. 2
(1) Sunt supuse aprobării ministerului, în ceea ce privește prețul, medicamentele care se eliberează pe bază de prescripție medicală, a căror punere pe piață este autorizată de Agenția Națională a Medicamentului și a Dispozitivelor Medicale sau în baza deciziei Comisiei Europene acordate conform procedurii centralizate în condițiile legii, precum și medicamentele autorizate pentru nevoi speciale.
(2) Cu excepția situației prevăzute la art. 5 alin. (3) este interzisă comercializarea pe teritoriul României a medicamentelor pentru care ministerul nu a emis ordin de aprobare a prețului.
(3) Prețul medicamentelor OTC se stabilește și se modifică în mod liber. Prețul medicamentelor OTC nou-autorizate pentru punere pe piață, precum și prețul modificat, stabilit de deținătorul APP sau de reprezentant, se notifică la minister în termen de 30 de zile de la momentul punerii pe piață.
(4) Prin excepție de la alin. (3), sunt supuse aprobării ministerului în conformitate cu prevederile prezentelor norme prețurile medicamentelor OTC care se prescriu și se eliberează pe bază de prescripție medicală și se regăsesc în lista cuprinzând denumirile comune internaționale corespunzătoare medicamentelor de care beneficiază asigurații, cu sau fără contribuție personală, pe bază de prescripție medicală, în sistemul de asigurări sociale de sănătate, precum și denumirile comune internaționale corespunzătoare medicamentelor care se acordă în cadrul programelor naționale de sănătate.
(5) Prețul medicamentelor magistrale și oficinale se stabilește în mod liber.“
2. La articolul 3, litera h) se modifică și va avea următorul cuprins:
"h)preț de referință generic - preț în lei maximal de vânzare al medicamentului generic, precum și al medicamentului inovativ pentru care există medicament/e generic/e cu preț aprobat în conformitate cu prezentele norme;“.
3. La articolul 3, după litera m) se introduc două noi litere, literele n) și o), cu următorul cuprins:
"n) Catalogul public național al prețurilor, denumit în continuare Catalog public - catalog cuprinzând prețurile maximale ale medicamentelor de uz uman valabile în România, aprobat prin ordin al ministrului sănătății;
o) Catalogul național al prețurilor medicamentelor autorizate de punere pe piață în România denumit în continuare Canamed- catalog cuprinzând prețurile maximale ale medicamentelor utilizate/comercializate de către furnizorii de servicii medicale sau medicamente aflați în relație contractuală cu Ministerul Sănătății, casele de asigurări de sănătate și/sau direcțiile de sănătate publică județene și a municipiului București, aprobat prin ordin al ministrului sănătății“.
4.Articolul 4 se modifică și va avea următorul cuprins:
"Art. 4
În cuprinsul prezentelor norme, prin preț notificat sau supus aprobării ministerului se înțelege exclusiv prețul de producător, adică prețul CIP conform INCOTERMS 2000.“
5.Articolul 5 se modifică și va avea următorul cuprins:
"Art. 5
(1) Ordinul privind aprobarea prețului medicamentului se emite în termen de 90 de zile de la primirea cererii depuse de deținătorul APP sau de reprezentant, inclusiv toată documentația aferentă, conform prezentelor norme.
(2) Dacă informațiile din cadrul cererii sunt incomplete, Ministerul Sănătății înștiințează solicitantul asupra acestui aspect, în maximum 30 de zile de la depunere, și solicită completarea dosarului cu informațiile necesare, urmând a emite ordinul de aprobare a prețului sau decizia de respingere a propunerii de preț, în termen de 90 de zile de la primirea informațiilor solicitate.
(3) În lipsa emiterii ordinului de aprobare a prețului sau a deciziei de respingere a propunerii de preț, după caz, în cadrul perioadei mai sus menționate, solicitantul devine împuternicit să comercializeze medicamentele la prețul propus cu respectarea adaosurilor stabilite prin prezentele norme pentru activitățile de comercializare angro și en detail.
(4) Prețul de producător este propus de deținătorul APP sau de reprezentant, în lei.
(5) Prețul medicamentelor din Canamed trebuie să fie mai mic sau cel mult egal cu cel mai mic preț al aceluiași medicament din lista țărilor cu care se efectuează comparația, prevăzute la art. 6. Pentru efectuarea analizei comparative, transformarea prețurilor de producător din alte valute în lei se face luându-se în considerare cursul de schimb valutar folosit la alcătuirea bugetului pe anul în curs. Pentru alte valute decât euro se folosește cursul de schimb mediu prognozat de Comisia Națională de Prognoză.
(6) În situația în care prețul de producător în țările de comparație este înregistrat la altă formă de ambalare, se va lua în analiză forma de ambalare cea mai apropiată de cea solicitată pentru aprobarea prețului în România.
(7) Anual, Ministerul Sănătății poate modifica prin ordin al ministrului sănătății lista țărilor luate ca etalon de comparație, în funcție de posibilitatea culegerii datelor necesare.
(8) Prețul se aprobă pentru o perioadă limitată de un an, calculată de la data aprobării prin ordin al ministrului sănătății.
(9) Prețurile medicamentelor aprobate ulterior analizei anuale efectuate în condițiile art. 15 sunt valabile până la data următoarei analize.
(10) Cu 120 de zile înainte de data expirării termenului în condițiile alin. (8) și (9), deținătorul APP sau reprezentantul este obligat să transmită ministerului noua documentație de aprobare a prețului, conform art. 6, în vederea reaprobării prețului de către minister.
(11) În cazul în care deținătorul de APP sau reprezentantul acestuia nu îndeplinește obligațiile prevăzute la alin. (10), se aplică prevederile art. 6 alin. (5)-(10).“
6.Articolul 6 se modifică și va avea următorul cuprins:
"Art. 6
(1) În vederea aprobării prețurilor medicamentelor de uz uman, precum și pentru reanalizarea prețurilor prevăzută la art. 15, solicitantul trebuie să depună la Ministerul Sănătății, structura de specialitate, următoarele documente, cu respectarea prevederilor prezentelor norme:
a) cerere-tip, conform anexei nr. 1, prin care deținătorul de APP sau reprezentantul solicită aprobarea în condițiile prezentelor norme a nivelului de preț de producător propus în lei, împreună cu o declarație pe propria răspundere privind conformitatea prețului propus cu prezentele norme, inclusiv sub aspectul nivelului minim de comparație prevăzut la art. 5 alin. (5) sub sancțiunea prevăzută de Legea nr. 286/2009 privind Codul penal, cu modificările și completările ulterioare, referitoare la falsul în declarații. Cererea este semnată de către reprezentantul legal al deținătorului de APP sau al reprezentantului;
b) copie a APP sau a deciziei Comisiei Europene emise în cadrul procedurii centralizate;
c) copie de pe anexele APP sau ale deciziei Comisiei Europene emise în cadrul procedurii centralizate ori a autorizației de nevoi speciale;
d) comparația cu prețul de producător autorizat în:
- Republica Cehă;
- Republica Bulgaria;
- Republica Ungară;
- Republica Polonă;
- Republica Slovacă;
- Republica Austria;
- Regatul Belgiei;
- Republica Italiană;
- Lituania;
- Spania;
- Grecia;
- Germania,
cu prezentarea de către deținătorul APP sau reprezentant de copii de pe cataloagele existente pe piețele respective, în vigoare la data depunerii documentației;
e) declarație pe propria răspundere a deținătorului APP sau a reprezentantului, conform anexei nr. 2.
(2) Când medicamentul nu are preț în niciuna dintre țările prevăzute la alin. (1), prețul se compară cu cel din țara de origine; în acest caz, documentația depusă include și o copie de pe catalogul de prețuri de pe piața respectivă.
(3) În cazul în care, în urma verificărilor comparative, se constată că medicamentul nu are preț înregistrat nici în țările din lista de comparație și nici în țara de origine, se aprobă prețul propus, care, în cazul medicamentelor generice sau al medicamentului inovativ pentru care există medicament/e generic/e cu preț aprobat, nu poate depăși prețul de referință generic, iar la expirarea termenului prevăzut la art. 5 alin. (8) și (9) se verifică situația comparativă prin depunerea de către deținătorul APP sau de către reprezentant a documentației, în conformitate cu prevederile art. 6.
(4) Solicitarea aprobării prețurilor de producător pentru produsele autorizate de punere pe piață se face în conformitate cu APP eliberată de Agenția Națională a Medicamentului și a Dispozitivelor Medicale sau cu autorizația pentru nevoi speciale, respectiv cu decizia Comisiei Europene emisă în cadrul procedurii centralizate, sub aspectul identificării produsului.
(5) În cazul în care prețul propus de către deținătorul de APP sau reprezentant nu este în conformitate cu prezentele norme, inclusiv sub aspectul nivelului minim de comparație prevăzut la art. 5 alin. (5), ministerul comunică solicitantului o decizie de respingere a propunerii de preț cuprinzând motivele neaprobării prețului propus, precum și nivelul prețului stabilit de minister conform prezentelor norme.
(6) În situația neacceptării prețului stabilit de minister, solicitantul poate comercializa medicamentele la prețul aprobat anterior până la epuizarea stocurilor existente, dar nu mai mult de 6 luni de la data deciziei prevăzute la alin. (5).
(7) În situația prevăzută la alin. (6), la epuizarea stocurilor existente, dar nu mai mult de 6 luni de la data deciziei de respingere a propunerii de preț, solicitantul nu va mai putea comercializa medicamentul pe teritoriul României.
(8) În situația în care, în termen de 90 de zile de la data comunicării deciziei de respingere a propunerii de preț, deținătorul de APP sau reprezentantul transmite ministerului acceptarea prețului stabilit conform art. 5 alin. (5), prețul este aprobat în conformitate cu prevederile prezentului ordin.
(9) În situația în care solicitantul comunică ministerului acceptarea prețului stabilit de minister după expirarea termenului de la alin. (8), prețul este aprobat la un nivel stabilit conform cu prevederile prezentului ordin diminuat cu 5% pentru o perioadă de 12 luni, aplicabil de la data aprobării.
(10) Ministerul Sănătății face publice sancțiunile aplicate conform prezentului articol prin înregistrarea unei mențiuni în acest sens la adresa www.ms-ro.preturi.ro, secțiunea «Sancțiuni».
(11) Dacă medicamentul nu a fost inclus încă pe lista cuprinzând denumirile comune internaționale corespunzătoare medicamentelor de care beneficiază asigurații, cu sau fără contribuție personală, pe bază de prescripție medicală, în sistemul de asigurări sociale de sănătate, precum și denumirile comune internaționale corespunzătoare medicamentelor care se acordă în cadrul programelor naționale de sănătate, sancțiunea constă în neincluderea pe lista menționată până la data aprobării prețului prin ordin.
(12) Oricând în cursul termenului pentru care prețul este valabil, deținătorul APP sau reprezentantul poate diminua prețul de producător aprobat inițial de către minister. Prețul de producător diminuat se comunică Ministerului Sănătății în vederea aprobării prin ordin.“
7.La articolul 7, alineatele (2)-(5) se abrogă.
8.Articolul 8 se modifică și va avea următorul cuprins:
"Art. 8
(1) Prețul medicamentului generic se propune de către deținătorul APP sau reprezentant prin comparație cu prețul acestui medicament în țările de comparație, fără a putea depăși prețul de referință generic.
(2) Prețul de referință generic se aprobă de către minister o singură dată, la data solicitării de preț pentru primul medicament generic, și reprezintă 65% din prețul medicamentului inovativ al cărui generic este, valabil la data solicitării.
(3) În situația prevăzută la alin. (2), în cazul în care nu există preț aprobat pentru medicamentul inovativ, pentru stabilirea prețului de referință generic se aplică în mod corespunzător prevederile art. 5 alin. (5) și ale art. 6 alin. (2).
(4) În cazul în care în urma verificărilor comparative se constată că medicamentul generic nu are preț în regi strat nici în țările din lista de comparație și nici în țara de origine, prețul de referință generic se stabilește la nivelul prețului propus pentru medicamentul generic.
(5) Prețurile de referință generice se aprobă prin ordin al ministrului sănătății pentru o perioadă de un an de zile.
(6) Prevederile alin. (2)-(5) se aplică în mod corespunzător și medicamentelor biosimilare.“
9.Articolul 81se modifică și va avea următorul cuprins:
"Art. 81
(1) După data de 1 ianuarie 2016, la efectuarea reanalizării în condițiile art. 15, prețurile medicamentelor inovative se propun de către deținătorul de APP sau de către reprezentant prin comparație cu prețurile acestor medicamente în țările prevăzute la art. 6, fără a putea depăși prețul de referință generic.
(2) În cazul netransmiterii propunerilor de preț prevăzute la alin. (1) se aplică în mod corespunzător prevederile art. 6 alin. (5)-(10).“
10.Articolul 82se abrogă.
11.Articolul 101se modifică și va avea următorul cuprins:
"Art. 101
În cazul în care prețul medicamentelor pentru nevoi speciale nu este în conformitate cu prezentele norme, Ministerul Sănătății poate aproba temporar prețul propus pe perioada de valabilitate a autorizației de nevoi speciale.“
12.Articolul 11 se modifică și va avea următorul cuprins:
"Art. 11
Ministerul afișează în mod transparent prețurile aprobate prin Catalogul public al prețurilor pe pagina de web www.ms-preturi.ro.“
13. La articolul 13, alineatele (2), (5), (8) și (9) se modifică și vor avea următorul cuprins:
"(2) În cazul unei solicitări de creștere a prețului medicamentului, aceasta se poate efectua numai cu respectarea prevederilor prezentelor norme.
_
(5) În situația în care Ministerul Sănătății nu aprobă majorarea de preț solicitată, decizia de respingere a propunerii de preț conține motivele de refuz ce vor fi comunicate solicitantului. În lipsa acestei decizii în cadrul mai sus-menționatei perioade, solicitantul are dreptul să comercializeze produsele la prețul de producător maximal propus, conform art. 5 alin. (3).
_
(8) Ministerul Sănătății se asigură că ordinul de aprobare a prețului sau decizia de respingere a propunerii de preț, după caz, privind aceste cereri sunt comunicate solicitantului în termen de 90 de zile. Dacă informațiile cuprinse în cerere sunt incomplete, Ministerul Sănătății înștiințează solicitantul asupra informațiilor necesare și emite o decizie finală în termen de 90 de zile de la primirea acestor informații.
(9) Dacă se acceptă derogarea prevăzută la alin. (7), Ministerul Sănătății aprobă prin ordin majorarea de preț.“
14.Articolul 14 se modifică și va avea următorul cuprins:
"Art. 14
(1) Ordinele de aprobare a prețurilor și deciziile de respingere a propunerilor de preț pot fi atacate de persoanele care se consideră vătămate în conformitate cu prevederile Legii contenciosului administrativ nr. 554/2004, cu modificările și completările ulterioare.
(2) Ordinele de aprobare a prețurilor și deciziile de respingere a propunerilor de preț sunt motivate pe baza criteriilor obiective și justificabile prevăzute de prezentele norme.
(3) Odată cu emiterea ordinelor de aprobare a prețurilor și a deciziilor de respingere a a propunerilor de preț, solicitanții sunt informați și asupra căilor de atac conform legislației în vigoare și asupra termenului în care pot fi exercitate acestea.“
15.Articolul 15 se modifică și va avea următorul cuprins:
"Art. 15
(1) Prețurile medicamentelor autorizate în condițiile legii sunt reanalizate anual conform prevederilor prezentului ordin.
(2) Prețurile medicamentelor autorizate în condițiile legii pot fi reanalizate și ori de câte ori condițiile macroeconomice o impun sau atunci când se constată că apar modificări în prețurile țărilor de comparație prevăzute la art. 6.“
16. La articolul 16 alineatul (1), punctul 2 se modifică și va avea următorul cuprins:
"2. Actualizarea prețurilor generice de referință se determină pe baza următoarei formule:
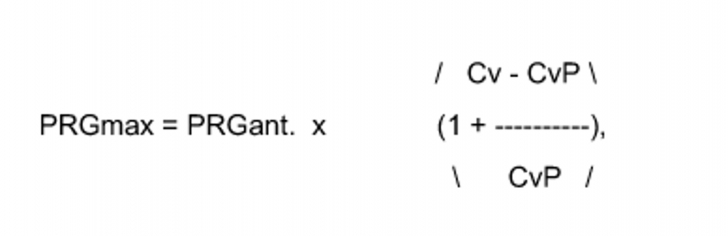
în care:
- PRGmax - prețul generic de referință actualizat;
- PRGant. - prețul generic de referință anterior;
- Cv- curs de schimb valutar leu/euro utilizat în alcătuirea bugetului pentru anul în curs;
- CvP - curs de schimb valutar leu/euro utilizat în alcătuirea bugetului pentru anul precedent.“
17.Articolul 17 se modifică și va avea următorul cuprins:
"Art. 17
Actualizarea prețurilor generice de referință pentru toate medicamentele se face ori de câte ori se efectuează reanalizarea prețurilor conform prevederilor art. 15.“
18.Articolul 18 se modifică și va avea următorul cuprins:
"Art. 18
(1) Prețurile de producător, cu ridicata și cu amănuntul, înscrise în Catalogul public, sunt prețuri maximale de vânzare în România.
(2) Prețurile de producător, cu ridicata și cu amănuntul, înscrise în Canamed, sunt prețuri maximale ale medicamentelor utilizate/comercializate de către furnizorii de servicii medicale sau medicamente aflați în relație contractuală cu Ministerul Sănătății, casele de asigurări de sănătate și/sau direcțiile de sănătate publică județene și a municipiului București și nu pot fi depășite de către aceștia.
(3) Facturarea la prețurile înscrise în Catalogul public se face numai pe baza unei notificări expres formulate în acest sens.“
19.La articolul 22, alineatul (1) se abrogă.
20. La articolul 22, alineatul (2) se modifică și va avea următorul cuprins:
"(2) Trimestrial sau ori de câte ori este nevoie, în temeiul prezentelor norme, Canamedul este adus la zi prin includerea, modificarea sau excluderea prețurilor.“
21.La articolul 22, alineatul (3) se abrogă.
22. La articolul 22, alineatul (4) se modifică și va avea următorul cuprins:
"(4) Comunicarea prețurilor pentru medicamentele cuprinse în Canamed către Casa Națională de Asigurări de Sănătate se face de către Ministerul Sănătății trimestrial, în vederea actualizării aplicației informatice. Informarea operatorilor economici distribuitori și detailisti se face de către deținătorul APP sau de reprezentant.“
23. După articolul 23 se introduc două noi articole, articolele 231 și 232, cu următorul cuprins:
"Art. 231
(1) Pentru medicamentele generice care au preț aprobat la data intrării în vigoare a prezentului ordin, prețul de referință generic se aprobă de către minister o singură dată și reprezintă 65% din prețul medicamentului inovativ calculat în condițiile prezentelor norme.
(2) În situația prevăzută la alin. (1), în cazul în care nu există preț aprobat pentru medicamentul inovativ, pentru stabilirea prețului de referință generic se stabilește la nivelul celui mai mare preț generic calculat în condițiile prezentelor norme.
Art. 232
Anexele nr. 1 și 2 fac parte integrantă din prezentele norme.“
24.Articolul 25 se abrogă.
25.Anexa nr. 2 la norme se modifică și se înlocuiește cu anexa care face parte integrantă din prezentul ordin.
Art. II
Pentru anul 2015, prețurile se aprobă pe baza documentației depuse în conformitate cu reglementările în vigoare la data primirii cererilor.
Art. III
Ordinul ministrului sănătății nr. 245/2012 pentru aprobarea prețurilor la medicamentele de uz uman cuprinse în Catalogul național al prețurilor medicamentelor de uz uman autorizate de punere pe piață în România, publicat în Monitorul Oficial al României, Partea I, nr. 190 din 23 martie 2012, cu modificările și completările ulterioare, se modifică după cum urmează:
1. În cuprinsul ordinului, sintagma "Catalogul național al prețurilor medicamentelor autorizate de punere pe piață în România“ se înlocuiește cu sintagma "Catalogul public național al prețurilor.“
2. Termenul prevăzut la art. 2 se prorogă pentru un termen de 90 de zile de la data publicării prezentului ordin în Monitorul Oficial al României, Partea I.
Art. IV
Prezentul ordin se publică în Monitorul Oficial al României, Partea I.
p. Ministrul sănătății,
Gabriel Florin Pușcău,
secretar general
ANEXĂ
(Anexa nr. 2 la norme)
DECLARAȚIE
Subsemnata/Subsemnatul, .........., deținătoare/deținător a/al CI/BI/P .........., cu domiciliul în .........., în calitate de reprezentant împuternicit al .........., cu sediul în .........., în calitate de:
◽ deținător al autorizației de punere pe piață;
◽ reprezentant al deținătorului autorizației de punere pe piață
(Se bifează în mod corespunzător.),
declar pe propria răspundere, sub sancțiunea prevăzută de Legea nr. 286/2009 privind Codul penal, cu modificările și completările ulterioare, referitoare la falsul în declarații, că toate informațiile cuprinse în documentația de avizare a prețului, în special informațiile utilizate la calculul prețului medicamentului respectiv, sunt complete și corecte, precum și faptul că respectă integral modul de calcul al prețului prevăzut în Normele privind modul de calcul al prețurilor la medicamentele de uz uman, aprobate prin Ordinul ministrului sănătății nr. 75/2009, cu modificările și completările ulterioare.
Prezenta declarație face parte din documentația de avizare prevăzută în Normele privind modul de calcul al prețurilor la medicamentele de uz uman, aprobate prin Ordinul ministrului sănătății nr. 75/2009, cu modificările și completările ulterioare.
Semnătura
..........
L.S.
| ← Ordinul MAI nr. 52/2015 - modificarea art. 6 alin. (3) din... | Rectificare → |
|---|








